Erstmals aktiv bewegliches Zellskelett-Membran-System gebaut
Künstliche Zellen machen ihre ersten Schritte
2014-09-04 – Nachrichten aus dem Physik-Department

Unterschiedlich geformte Vesikel. Bild: Christoph Hohmann, Nano Initiative Munich
Eine Zelle ist ein komplexes Gebilde mit einem ausgeklügelten Stoffwechsel. Ihr evolutionärer Vorfahr, die Urzelle, bestand hingegen nur aus einer Membran und wenigen Molekülen. Dabei handelte es sich um ein minimalistisches, aber bereits perfekt arbeitendes System.
Zurück zu den Ursprüngen der Zelle lautet daher auch das Motto der Gruppe von Professor Andreas Bausch, Mitglied des Exzellenzclusters Nanosystems Initiative Munich (NIM), und seiner internationalen Partner. Ihr Traum ist es, mit wenigen Grundzutaten ein einfaches Zellmodell mit einer bestimmten Funktion zu schaffen. Sie folgen damit dem Prinzip der Synthetischen Biologie, die einzelne Zellbausteine zu künstlichen biologischen Systemen mit neuen Eigenschaften zusammenfügt.
Die Vision der Biophysiker und ihrer internationalen Partner ist ein zellähnliches Modell mit einer biomechanischen Funktion. Es soll sich ohne Einfluss von außen von selber aktiv bewegen oder verformen. In ihrer aktuellen Veröffentlichung in Science präsentieren sie, wie ihnen die Umsetzung gelungen ist.
Die Wunderkugel
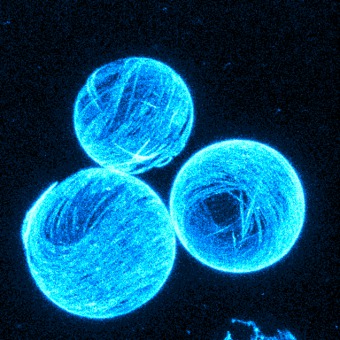
Das Modell der Biophysiker setzt sich zusammen aus einer Membranhülle, zwei verschiedenen Sorten von Biomolekülen und einer Art Kraftstoff. Die Hülle, auch als Vesikel bezeichnet, besteht aus einer zweischichtigen Lipidmembran, analog zu natürlichen Zellmembranen. Die Vesikel füllen die Wissenschaftler mit Mikrotubuli, einem röhrenförmigen Bestandteil des Zellskelettes, und mit Kinesinmolekülen. Kinesine dienen gewöhnlich in der Zelle als molekulare Motoren, die entlang der Mikrotubuli Zellbausteine transportieren. Im Experiment schieben diese Motoren die Röhrchen permanent aneinander entlang. Dafür benötigen Kinesine den Energieträger ATP, der im Versuchsansatz ebenfalls vorhanden ist.
Die Mikrotubuli-Röhrchen bilden im Experiment physikalisch gesehen direkt unter der Membran einen zweidimensionalen Flüssigkristall, der ständig in Bewegung ist. “Man kann sich diese Flüssigkristallschicht vorstellen wie Baumstämme, die auf einem See treiben”, erklärt Felix Keber, Erstautor der Studie. “Wird es zu dicht, ordnen sie sich parallel an und können doch noch aneinander vorbei treiben.”
Fehler auf Wanderschaft
Entscheidend für die Deformation der künstlichen Zellkonstruktion ist nun, dass der Flüssigkristall schon im Ruhezustand in Kugelform immer Fehlstellen bilden muss. Mathematiker erklären solche Phänomene mit dem Poincare-Hopf Theorem, oder anschaulich dem “Satz des Igels”. Denn so wie man die Stacheln eines Igels nie bürsten kann, ohne dass eine kahle Stelle entsteht, können sich auch die Mikrotubuli nicht komplett gleichmäßig von innen an die Membranwand anlagern. Die Röhrchen stellen sich daher an einige Stellen leicht quer zueinander und dies in einer ganz bestimmten Geometrie. Da sich im Fall des Experiments der Münchner Wissenschaftler die Mikrotubuli durch die Aktivität der Kinesinmoleküle zudem ständig aneinander entlang bewegen, wandern auch die Fehlstellen. Erstaunlicherweise tun sie dies auf eine sehr gleichmäßige und periodische Art und Weise, oszillierend zwischen zwei definierten Anordnungen.
Stachelförmige Fortsätze
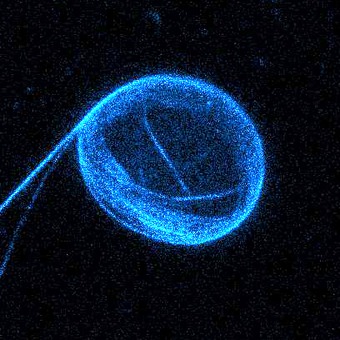
Solange der Vesikel eine Kugelform bildet, haben die Fehlstellen noch keinen Einfluss auf die äußere Form der Membran. Aber sobald ihm über Osmose Wasser entzogen wird, beginnt er sich durch die Bewegungen im Inneren zu verformen. Verliert der Vesikel mehr und mehr Wasser, so entstehen aus der überschüssigen Membran sogar stachelförmige Fortsätze, wie sie einige Einzeller zur Fortbewegung nutzen.
Dabei bilden sich faszinierend viele verschiedene Formen und Dynamiken. Was auf den ersten Blick beliebig erscheint, gehorcht in Wahrheit physikalischen Gesetzen. Und so ist es den internationalen Wissenschaftlern gelungen, einige Gesetzmäßigkeiten wie das periodische Verhalten der Vesikel zu entschlüsseln. Auf deren Grundlage lassen sich wiederum Vorhersagen für andere Systeme treffen.
“Mit unserem synthetischen biomolekularen Modell haben wir eine ganz neue Möglichkeit geschaffen, um minimale Zellmodelle zu entwickeln”, erklärt Bausch. “Es ist ideal geeignet, um modular die Komplexität zu erhöhen und so kontrolliert zelluläre Prozesse, wie Zellmigration oder Zellteilung, nachzubauen. Dass das künstlich geschaffene System vollständig physikalisch beschrieben werden kann, nährt die Hoffnung, dass wir bei den nächsten Schritten auch die physikalischen Gesetzmäßigkeiten der vielfältigen Zellverformungen entdecken können.”
Die Arbeit der Münchner Biophysiker entstand in Zusammenarbeit mit Kollegen der Brandeis University, Waltham, USA, der International School for Advanced Studies, Triest, Italien sowie der Syracuse University, New York, USA.
Veröffentlichung
- Topology and dynamics of active nematic vesicles
- Felix C. Keber, Etienne Loiseau, Tim Sanchez, Stephen J. DeCamp, Luca Giomi, Mark J. Bowick, M. Cristina Marchetti, Zvonimir Dogic and Andreas R. Bausch
Videomaterial
Kontakt
- Prof. Andreas Bausch
- Technische Universität MünchenJames-Franck-Str. 185748 GarchingTel.: +49 89 289-12408E-Mail: abausch@ph.tum.de